Verwenden Sie Ihre Zeit auf den Inhalt statt der Form
Als weltweit marktführende Softwarelösung ermöglicht Ihnen der BAYOOSOFT Risk Manager die einfache und effiziente Erstellung der Technischen Dokumentation von Medizinprodukten und In-Vitro-Diagnostika.
Alle Informationen werden in einer klar strukturierten Umgebung erfasst und die Dateien revisionssicher gespeichert sowie feingranular dynamisch miteinander verbunden – so gehören nachträgliche Verfälschungen oder mögliche Datenverluste der Vergangenheit an. Sie vermeiden darüberhinaus eine redundante Datenhaltung und können Berichte jederzeit mit den aktuellsten Daten einfach per Knopfdruck generieren.
Ihr Entwicklungs- und Zulassungsprozess wird mit BAYOOSOFT Risk Manager beschleunigt: Sie konzentrieren sich auf das Wesentliche und steigern Ihre Produktivität.
Lernen Sie den Risk Manager 30-Tage kostenfrei im Rahmen einer TRIAL kennen!
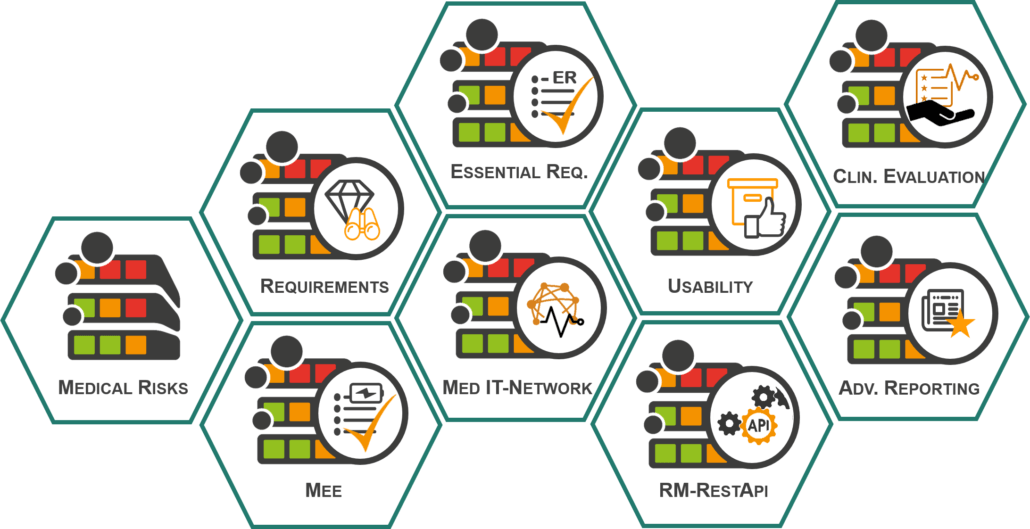
Die Module des Risk Manager auf einen Blick
Informieren Sie sich in unseren Vorträgen zur Medica 2020
Montag, 16.11.2020
10:00 Uhr: Fokus auf Inhalt statt Form – Technische Dokumentation mit dem Risk Manager
Die regulatorischen Anforderungen haben für die Entwicklung und in Verkehr Bringung von Medizinprodukten in den vergangen Jahren kontinuierlich zugenommen. Die EU-Medizinprodukteverordnung sorgt für zahlreiche Diskussionen. Für die Hersteller von Medizinprodukten bedeutet dies einen kontinuierlich steigenden Dokumentationsaufwand. Als weltweit marktführende Softwarelösung unterstützt der BAYOOSOFT Risk Manager Sie bei der Erstellung der Technischen Dokumentation von Medizinprodukten und In-Vitro-Diagnostika.
Auch Sie möchten Ihren Weg zur Zulassung beschleunigen? Lernen Sie den Risk Manager im Rahmen unserer Präsentation näher kennen. Verpassen Sie nicht die Gelegenheit, sich risikofrei und aus erster Hand mit der neusten Version des validierten Zulassungsbeschleunigers vertraut zu machen.
11:30 Konformitätsbericht des medizinisch elektrischen Geräts nach IEC EN 60601-1 - So wird der Elefant zur Mücke
Bei Ausgabe 3.1 der IEC 60601-1 handelt es sich um eine komplette Überarbeitung der Norm für medizinisch elektrische Geräte. Das Risikomanagement gemäß ISO 14971 ist damit ein wesentlicher Bestandteil des Sicherheitskonzeptes von Medizingeräten. Um redundante und ggf. widersprüchliche Datenstände zu vermeiden, stehen die Hersteller von medizinischen elektrischen Systemen bei über 400 Seiten an Anforderungen und mehr als 1.500 Prüfungen auf Anwendbarkeit vor der Herausforderung, hier einen effizienten und sicheren Prozess einzuführen. Wir zeigen Ihnen anhand dem BAYOOSOFT Risk Manager, wie Sie diesen Prozess systematisch und interaktiv um bis zu 62% beschleunigen können.
14:00 Schluss mit Sisyphos - kinderleichte Anpassung und Versionierung der Technischen Dokumentation
Bei der initialen Erstellung der Technischen Dokumentation für ein Medizinprodukt ist der Prozess noch relativ klar und strukturiert. Von Zweckbestimmung und Risikoklassifizierung, über Anforderungen und Risikoakte hinweg, werden alle Aspekte Stück für Stück berücksichtigt.
Doch wie geht man vor, wenn aufgrund von Marktbeobachtung oder anderen Auslösern die Technische Dokumentation überarbeitet werden muss? An welchen Stellen müssen die Änderungen umgesetzt werden und wie erkennt man später in verschiedenen Versionen die Unterschiede? Wir zeigen Ihnen, wie solche Änderungen an der Technischen Dokumentation durch die projekt- und versionsbasierte Vorgehensweise und die feingranular dynamisches Datenverknüpfung des BAYOOSOFT Risk Manager zum Kinderspiel werden.
15:30 Risiken im Softwarelebenszyklus IEC 62304 – toolgestützte Traceability
Die IEC 62304 definiert einen Rahmen für Lebenszyklen von MP-Software. Meist werden Traceability Matrizen herangezogen, um eine konforme Entwicklung nachzuweisen – besonders bei großen Systemen wird es anspruchsvoll. Wir zeigen Ihnen, wie der Einsatz digitaler Tools diesen Prozess sowie eine nahtlose Integration ins Risikomanagement unterstützen können und somit die Zulassung beschleunigen.
Dienstag, 17.11.2020
10:00 Uhr: Fokus auf Inhalt statt Form – Technische Dokumentation mit dem Risk Manager
Die regulatorischen Anforderungen haben für die Entwicklung und in Verkehr Bringung von Medizinprodukten in den vergangen Jahren kontinuierlich zugenommen. Die EU-Medizinprodukteverordnung sorgt für zahlreiche Diskussionen. Für die Hersteller von Medizinprodukten bedeutet dies einen kontinuierlich steigenden Dokumentationsaufwand. Als weltweit marktführende Softwarelösung unterstützt der BAYOOSOFT Risk Manager Sie bei der Erstellung der Technischen Dokumentation von Medizinprodukten und In-Vitro-Diagnostika.
Auch Sie möchten Ihren Weg zur Zulassung beschleunigen? Lernen Sie den Risk Manager im Rahmen unserer Präsentation näher kennen. Verpassen Sie nicht die Gelegenheit, sich risikofrei und aus erster Hand mit der neusten Version des validierten Zulassungsbeschleunigers vertraut zu machen.
11:30 Konformitätsbericht des medizinisch elektrischen Geräts nach IEC EN 60601-1 - So wird der Elefant zur Mücke
Bei Ausgabe 3.1 der IEC 60601-1 handelt es sich um eine komplette Überarbeitung der Norm für medizinisch elektrische Geräte. Das Risikomanagement gemäß ISO 14971 ist damit ein wesentlicher Bestandteil des Sicherheitskonzeptes von Medizingeräten. Um redundante und ggf. widersprüchliche Datenstände zu vermeiden, stehen die Hersteller von medizinischen elektrischen Systemen bei über 400 Seiten an Anforderungen und mehr als 1.500 Prüfungen auf Anwendbarkeit vor der Herausforderung, hier einen effizienten und sicheren Prozess einzuführen. Wir zeigen Ihnen anhand dem BAYOOSOFT Risk Manager, wie Sie diesen Prozess systematisch und interaktiv um bis zu 62% beschleunigen können.
14:00 Schluss mit Sisyphos - kinderleichte Anpassung und Versionierung der Technischen Dokumentation
Bei der initialen Erstellung der Technischen Dokumentation für ein Medizinprodukt ist der Prozess noch relativ klar und strukturiert. Von Zweckbestimmung und Risikoklassifizierung, über Anforderungen und Risikoakte hinweg, werden alle Aspekte Stück für Stück berücksichtigt.
Doch wie geht man vor, wenn aufgrund von Marktbeobachtung oder anderen Auslösern die Technische Dokumentation überarbeitet werden muss? An welchen Stellen müssen die Änderungen umgesetzt werden und wie erkennt man später in verschiedenen Versionen die Unterschiede? Wir zeigen Ihnen, wie solche Änderungen an der Technischen Dokumentation durch die projekt- und versionsbasierte Vorgehensweise und die feingranular dynamisches Datenverknüpfung des BAYOOSOFT Risk Manager zum Kinderspiel werden.
15:30 Den Prozess der Klinischen Bewertung durch Toolunterstützung beschleunigen
Der Einsatz digitaler Tools kann Medizinprodukte-hersteller dabei unterstützen, den Prozess der klinischen Bewertung gemäß der Medizinprodukte-verordnung MDR 2017/745 an zentraler Stelle abzubilden, das Vorgehen zu vereinheitlichen und jederzeit nachvollziehbar zu dokumentieren und so diesen Teil des Qualitätsmanagements schneller und effizienter zu gestalten.
Mittwoch, 18.11.2020
10:00 Uhr: Fokus auf Inhalt statt Form – Technische Dokumentation mit dem Risk Manager
Die regulatorischen Anforderungen haben für die Entwicklung und in Verkehr Bringung von Medizinprodukten in den vergangen Jahren kontinuierlich zugenommen. Die EU-Medizinprodukteverordnung sorgt für zahlreiche Diskussionen. Für die Hersteller von Medizinprodukten bedeutet dies einen kontinuierlich steigenden Dokumentationsaufwand. Als weltweit marktführende Softwarelösung unterstützt der BAYOOSOFT Risk Manager Sie bei der Erstellung der Technischen Dokumentation von Medizinprodukten und In-Vitro-Diagnostika.
Auch Sie möchten Ihren Weg zur Zulassung beschleunigen? Lernen Sie den Risk Manager im Rahmen unserer Präsentation näher kennen. Verpassen Sie nicht die Gelegenheit, sich risikofrei und aus erster Hand mit der neusten Version des validierten Zulassungsbeschleunigers vertraut zu machen.
11:30 Konformitätsbericht des medizinisch elektrischen Geräts nach IEC EN 60601-1 - So wird der Elefant zur Mücke
Bei Ausgabe 3.1 der IEC 60601-1 handelt es sich um eine komplette Überarbeitung der Norm für medizinisch elektrische Geräte. Das Risikomanagement gemäß ISO 14971 ist damit ein wesentlicher Bestandteil des Sicherheitskonzeptes von Medizingeräten. Um redundante und ggf. widersprüchliche Datenstände zu vermeiden, stehen die Hersteller von medizinischen elektrischen Systemen bei über 400 Seiten an Anforderungen und mehr als 1.500 Prüfungen auf Anwendbarkeit vor der Herausforderung, hier einen effizienten und sicheren Prozess einzuführen. Wir zeigen Ihnen anhand dem BAYOOSOFT Risk Manager, wie Sie diesen Prozess systematisch und interaktiv um bis zu 62% beschleunigen können.
14:00 Schluss mit Sisyphos - kinderleichte Anpassung und Versionierung der Technischen Dokumentation
Bei der initialen Erstellung der Technischen Dokumentation für ein Medizinprodukt ist der Prozess noch relativ klar und strukturiert. Von Zweckbestimmung und Risikoklassifizierung, über Anforderungen und Risikoakte hinweg, werden alle Aspekte Stück für Stück berücksichtigt.
Doch wie geht man vor, wenn aufgrund von Marktbeobachtung oder anderen Auslösern die Technische Dokumentation überarbeitet werden muss? An welchen Stellen müssen die Änderungen umgesetzt werden und wie erkennt man später in verschiedenen Versionen die Unterschiede? Wir zeigen Ihnen, wie solche Änderungen an der Technischen Dokumentation durch die projekt- und versionsbasierte Vorgehensweise und die feingranular dynamisches Datenverknüpfung des BAYOOSOFT Risk Manager zum Kinderspiel werden.
15:30 Risiken im Softwarelebenszyklus IEC 62304 – toolgestützte Traceability
Die IEC 62304 definiert einen Rahmen für Lebenszyklen von MP-Software. Meist werden Traceability Matrizen herangezogen, um eine konforme Entwicklung nachzuweisen – besonders bei großen Systemen wird es anspruchsvoll. Wir zeigen Ihnen, wie der Einsatz digitaler Tools diesen Prozess sowie eine nahtlose Integration ins Risikomanagement unterstützen können und somit die Zulassung beschleunigen.
Donnerstag, 19.11.2020
10:00 Uhr: Fokus auf Inhalt statt Form – Technische Dokumentation mit dem Risk Manager
Die regulatorischen Anforderungen haben für die Entwicklung und in Verkehr Bringung von Medizinprodukten in den vergangen Jahren kontinuierlich zugenommen. Die EU-Medizinprodukteverordnung sorgt für zahlreiche Diskussionen. Für die Hersteller von Medizinprodukten bedeutet dies einen kontinuierlich steigenden Dokumentationsaufwand. Als weltweit marktführende Softwarelösung unterstützt der BAYOOSOFT Risk Manager Sie bei der Erstellung der Technischen Dokumentation von Medizinprodukten und In-Vitro-Diagnostika.
Auch Sie möchten Ihren Weg zur Zulassung beschleunigen? Lernen Sie den Risk Manager im Rahmen unserer Präsentation näher kennen. Verpassen Sie nicht die Gelegenheit, sich risikofrei und aus erster Hand mit der neusten Version des validierten Zulassungsbeschleunigers vertraut zu machen.
11:30 Konformitätsbericht des medizinisch elektrischen Geräts nach IEC EN 60601-1 - So wird der Elefant zur Mücke
Bei Ausgabe 3.1 der IEC 60601-1 handelt es sich um eine komplette Überarbeitung der Norm für medizinisch elektrische Geräte. Das Risikomanagement gemäß ISO 14971 ist damit ein wesentlicher Bestandteil des Sicherheitskonzeptes von Medizingeräten. Um redundante und ggf. widersprüchliche Datenstände zu vermeiden, stehen die Hersteller von medizinischen elektrischen Systemen bei über 400 Seiten an Anforderungen und mehr als 1.500 Prüfungen auf Anwendbarkeit vor der Herausforderung, hier einen effizienten und sicheren Prozess einzuführen. Wir zeigen Ihnen anhand dem BAYOOSOFT Risk Manager, wie Sie diesen Prozess systematisch und interaktiv um bis zu 62% beschleunigen können.
14:00 Schluss mit Sisyphos - kinderleichte Anpassung und Versionierung der Technischen Dokumentation
Bei der initialen Erstellung der Technischen Dokumentation für ein Medizinprodukt ist der Prozess noch relativ klar und strukturiert. Von Zweckbestimmung und Risikoklassifizierung, über Anforderungen und Risikoakte hinweg, werden alle Aspekte Stück für Stück berücksichtigt.
Doch wie geht man vor, wenn aufgrund von Marktbeobachtung oder anderen Auslösern die Technische Dokumentation überarbeitet werden muss? An welchen Stellen müssen die Änderungen umgesetzt werden und wie erkennt man später in verschiedenen Versionen die Unterschiede? Wir zeigen Ihnen, wie solche Änderungen an der Technischen Dokumentation durch die projekt- und versionsbasierte Vorgehensweise und die feingranular dynamisches Datenverknüpfung des BAYOOSOFT Risk Manager zum Kinderspiel werden.
15:30 Den Prozess der Klinischen Bewertung durch Toolunterstützung beschleunigen
Der Einsatz digitaler Tools kann Medizinprodukte-hersteller dabei unterstützen, den Prozess der klinischen Bewertung gemäß der Medizinprodukte-verordnung MDR 2017/745 an zentraler Stelle abzubilden, das Vorgehen zu vereinheitlichen und jederzeit nachvollziehbar zu dokumentieren und so diesen Teil des Qualitätsmanagements schneller und effizienter zu gestalten.